1. 理想气体模型的基本特点是
(A) 分子不断地作无规则运动、它们均匀分布在整个容器中
(B) 各种分子间有哪些用途相等,各种分子的体积大小相等
(C) 所有分子都可看作一个质点, 并且它们具备相等的能量
(D) 分子间无用途力, 分子本身无体积
答案:D
2. 关于物质临界状况的下列描述中, 不正确的是
(A) 在临界状况, 液体和蒸气的密度相同, 液体与气体无不同
(B) 每种气体物质都有一组特定的临界参数
C)在以p、V为坐标的等温线上, 临界点对应的重压就是临界重压
(D) 临界温度越低的物质, 其气体越易液化
答案:D
3. 对于实质气体, 下面的陈述中正确的是
(A) 不是任何实质气体都能在肯定条件下液化
(B) 处于相同对比状况的各种气体,可能没有相同的压缩因子
(C) 对于实质气体, 范德华方程应用最广, 并非由于它比其它状况方程更精准
(D) 临界温度越高的实质气体越不容易液化
答案:C
4. 理想气体状况方程pV=nRT表明了气体的p、V、T、n、这几个参数之间的定量关系,与气体类型无关。该方程事实上包含了三个气体定律,这三个气体定律是
(A) 波义尔定律、盖-吕萨克定律和分压定律
(B) 波义尔定律、阿伏加德罗定律和分体积定律
(C) 阿伏加德罗定律、盖-吕萨克定律和波义尔定律
(D) 分压定律、分体积定律和波义尔定律
答案:C
5. 什么在真实气体的恒温PV-P曲线中当温度足够低时会出现PV值先随P的增加而减少,然后随P的增加而上升,即图中T1线,当温度足够高时,PV值总随P的增加而增加,即图中T2线?
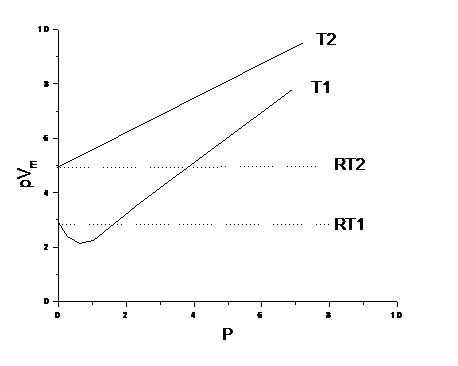
答:理想气体分子本身无体积,分子间无用途力。恒温时pV=RT,所以pV-p线为一直线。真实气体因为分子有体积且分子间有相互用途力,此两原因在不同条件下的影响大小不同时,其pV-p曲线就会出现极小值。真实气体分子间存在的吸引力使分子更挨近,因此在肯定重压下比理想气体的体积要小,使得pVRT。
当温度足够低时,因同样重压下,气体体积较小,分子间距较近,分子间相互吸引力的影响较显著,而当重压较低时分子的不可压缩性起得用途较小。所以真实气体都会出现pV值先随p的增加而减少,当重压增至较高时,不可压缩性所起有哪些用途显著增长,故pV值随重压增高而增大,最后使pVRT。如图中曲线T1所示。
当温度足够高时,因为分子动能增加,同样重压下体积较大,分子间距也较大,分子间的引力大大减弱。而不可压缩性相对说来起主要用途。所以pV值一直大于RT。如图中曲线T2所示。
6.为何温度升高时气体的粘度升高而液体的粘度降低?
答:依据分子运动理论,气体的定向运动可以看成是一层层的,分子本身无规则的热运动,会使分子在两层之间相互碰撞交换能量。温度升高时,分子热运动加剧,碰撞更频繁,气体粘度也就增加。但温度升高时,液体的粘度飞速降低,这是因为液体产生粘度是什么原因和气体完全不同,液体粘度的产生是因为分子间有哪些用途力。温度升高,分子间有哪些用途力减速弱,所以粘度降低。
7.重压对气体的粘度影响大吗?
答:重压增大时,分子间距减小,单位体积中分子数增加,但分子的平均自由程减小,两者抵消,因此重压增高,粘度不变。
8.两瓶不同类型的气体,其分子平均平动能相同,但气体的密度不同。问它们的温度是不是相同?重压是不是相同?为何?
答:温度相同。由于气体的温度只取决于分子平移的动能,两种不一样的气体若平移的动能相同则温度势必相同。但两种气体的重压是不一样的,由于气体的重压与气体的密度是成正比的。两种气体的密度不同,当然它们的重压就不同。



